본 컨텐츠는 AI를 이용한 컨텐츠로, AI기술이 가진 구조적 한계를 가지고 있습니다.
- 미국 FDA는 이전에 두 차례의 치료를 받은 후 3등급에 노출된 재발성 또는 불응성 다발성 골수종에 대해 Abecma를 승인했습니다.
- Abecma는 임상 3상 KarMMa-3 시험에서 표준 요법에 비해 무진행 생존 기간을 3배 연장했습니다.
- 이 개인 맞춤형 CAR T 세포 치료제는 질병 진행 또는 사망 위험을 51% 감소시키면서 의미 있는 무치료 간격을 제공합니다.
- 아벡마는 현재 미국, 일본, 스위스, EU에서 조기 사용 승인을 받았으며, 이는 전 세계에 아벡마를 공급하기 위한 BMS의 노력을 강조하는 것입니다.
- Abecma의 권장 용량 범위는 3억~5억1천만 개의 CAR 양성 T 세포이며, 잠재적 부작용에 관한 중요한 안전성 정보가 포함되어 있습니다.
[보도자료 원본 보기]
[기업개요]
2세븐 바이오는 세포 및 유전자 치료 회사로, 암에 대한 혁신적 치료법의 연구, 개발 및 상용화에 주력하고 있습니다. 투세븐 바이오는 T 세포 공학 기술과 렌티바이러스 벡터 유전자 전달 접근법에 대한 전문 지식, 세포 치료제의 연구, 개발 및 제조 경험, 암 환자를 위한 표적 세포 치료제를 개발하기 위해 선택적으로 배치할 수 있는 일련의 기술을 결합하여 접근합니다.
회사는 재발성 및 난치성 급성 골수성 백혈병(AML) 소아 환자 치료를 위한 SC-DARIC33, B세포 비호지킨 림프종(B-NHL) 환자 치료를 위한 bbT369 등 다수의 임상 프로그램과 MUC16을 표적으로 하는 조작된 CAR T 세포 치료제인 bbT4015 등 다수의 전임상 프로그램을 진행하고 있다.
또한 파트너사인 브리스톨 마이어스 스퀴브와 함께 미국 내 다발성 골수종 환자들에게 아벡마를 공급하고 있습니다.
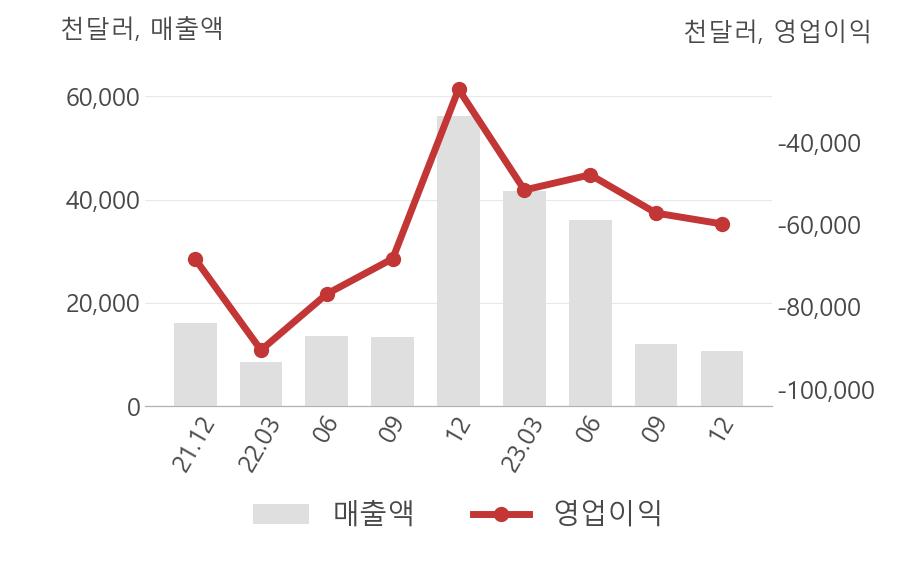
[최근실적추이]