본 컨텐츠는 AI를 이용한 컨텐츠로, AI기술이 가진 구조적 한계를 가지고 있습니다.
- 지브러 테라퓨틱스는 FDA가 니만-픽병 C형 치료제인 아리모클로몰에 대한 NDA 검토 기간을 2024년 9월 21일로 연장했다고 발표했습니다.
- 이 연장은 FDA의 요청에 따라 회사가 제공한 추가 분석을 검토하는 데 더 많은 시간이 필요했기 때문에 NDA를 대폭 수정해야 했기 때문입니다.
- 지연에도 불구하고 제브라는 아리모클로몰이 NPC 환자를 도울 수 있는 잠재력을 여전히 확신하고 있으며, 검토 과정에서 FDA와 긴밀히 협력해 나갈 것입니다.
- NPC 환자 옹호 커뮤니티는 NPC에 대한 치료제의 긴급한 필요성을 해결하기 위해 아리모클로몰을 FDA 승인 치료제로 지지하는 청원서를 FDA에 제출했습니다.
- 아리모클로몰은 2024년 9월 21일로 설정된 사용자 비용 목표일(PDUFA 날짜)에 따라 FDA와 EMA로부터 여러 차례 지정을 받았으며, Zevra는 가능한 한 빨리 환자들에게 이 약을 제공하기 위해 노력하면서 조기 접근 프로그램을 유지할 것입니다.
[보도자료 원본 보기]
[기업개요]
제브라 테라퓨틱스(Zevra Therapeutics, 이하 제브라)는 희귀질환 치료제 개발 회사입니다. 회사는 치료 옵션이 제한적이거나 전혀 없는 질병에 대한 치료법을 개발하는 데 주력하고 있습니다.
회사는 리간드 활성화 치료, 플랫폼 기술을 사용하여 승인된 약물의 속성 중 하나 이상을 개선할 수 있는 새로운 분자인 전구 약물을 발견하고 개발합니다.
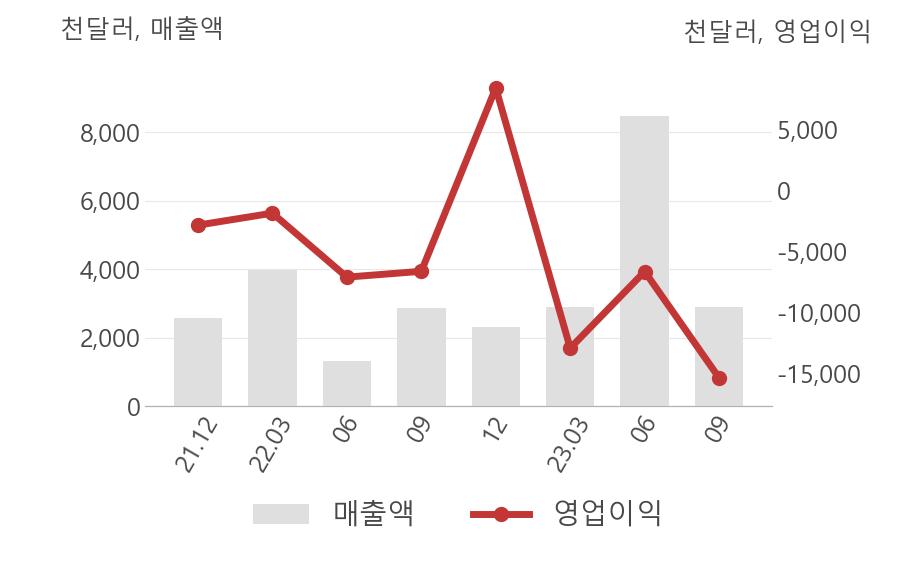
[최근실적추이]